Effet Dufour : Flux de Chaleur et Gradient de Concentration
Contexte : Au-delà de Fourier et Fick, les phénomènes couplés.
En thermodynamique classique, les lois de Fourier (transfert de chaleur) et de Fick (transfert de masse) décrivent des phénomènes de transport indépendants. Cependant, la Thermodynamique des Processus Irréversibles (TPI) révèle que ces flux sont souvent couplés. L'Effet DufourNommé d'après le physicien suisse Louis Dufour, cet effet décrit l'apparition d'un flux de chaleur (et donc un gradient de température) en réponse à un gradient de concentration dans un mélange. C'est l'effet réciproque de l'effet Soret (thermodiffusion)., ou thermo-diffusion inverse, est un de ces phénomènes : il décrit l'apparition d'un flux de chaleur induit non pas par un gradient de température, mais par un gradient de concentration. Bien que souvent négligeable dans les liquides, cet effet peut être significatif dans les mélanges gazeux et est crucial pour comprendre des processus allant de la séparation isotopique à certains phénomènes atmosphériques.
Remarque Pédagogique : Cet exercice illustre la puissance de la TPI pour décrire le monde réel. Nous allons quitter le cadre simplifié des lois de Fourier et Fick pour entrer dans celui, plus complet, des équations phénoménologiques d'Onsager. L'objectif est de quantifier un flux de chaleur qui n'existerait pas sans un flux de matière, une idée contre-intuitive mais fondamentale dans l'étude des systèmes hors équilibre.
Objectifs Pédagogiques
- Comprendre le concept de couplage entre flux de chaleur et flux de matière.
- Identifier les forces thermodynamiques et les flux associés dans un système binaire.
- Appliquer les équations phénoménologiques linéaires pour décrire les transports couplés.
- Isoler et calculer la contribution de l'effet Dufour au flux de chaleur total.
- Manipuler les coefficients phénoménologiques et comprendre les relations de réciprocité d'Onsager.
Données de l'étude
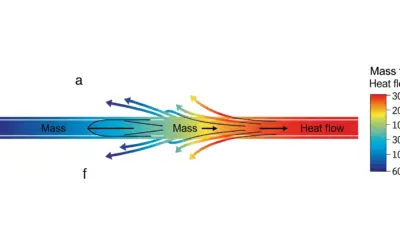
Schéma de la diffusion isotherme
| Paramètre | Symbole | Valeur | Unité |
|---|---|---|---|
| Température du système | \(T\) | 300 | \(\text{K}\) |
| Gradient de fraction molaire (He) | \(\nabla x_{\text{1}}\) | -0.8 | \(\text{m}^{-1}\) |
| Coefficient de diffusion thermique | \(D_{\text{T}}\) | \(1.5 \times 10^{-8}\) | \(\text{m}^2 \cdot \text{s}^{-1} \cdot \text{K}^{-1}\) |
| Coefficient de diffusion ordinaire | \(D_{\text{12}}\) | \(7.0 \times 10^{-5}\) | \(\text{m}^2 \cdot \text{s}^{-1}\) |
| Concentration molaire totale | \(c\) | 40 | \(\text{mol} \cdot \text{m}^{-3}\) |
| Conductivité thermique du mélange | \(\lambda\) | 0.1 | \(\text{W} \cdot \text{m}^{-1} \cdot \text{K}^{-1}\) |
Questions à traiter
- Identifier les flux et les forces thermodynamiques pertinents pour ce système.
- Écrire les équations phénoménologiques couplées pour le flux de chaleur \(J_{\text{q}}\) et le flux de diffusion \(J_{\text{1}}\).
- En utilisant la relation de réciprocité d'Onsager, exprimer le coefficient de Dufour en fonction du coefficient de thermodiffusion (Soret).
- Calculer la valeur du flux de chaleur \(J_{\text{q}}\) induit par l'effet Dufour en \(\text{W} \cdot \text{m}^{-2}\).
Les bases de la Thermodynamique des Processus Irréversibles
Avant de corriger l'exercice, rappelons les fondements de la TPI.
1. Flux et Forces :
La TPI décrit les systèmes hors équilibre à l'aide de couples de "flux" (\(J_{\text{i}}\)) et de "forces" (\(X_{\text{i}}\)). Un flux représente un transport (de chaleur, de matière, de charge...), tandis qu'une force est ce qui cause ce transport (un gradient de température, de concentration, de potentiel...). La production d'entropie locale, \(\sigma\), est la somme des produits de ces flux et forces : \(\sigma = \sum_{\text{i}} J_{\text{i}} X_{\text{i}} \ge 0\).
2. Équations Phénoménologiques :
Près de l'équilibre, on postule une relation linéaire entre les flux et les forces. Chaque flux peut dépendre de TOUTES les forces présentes :
\[ J_{\text{i}} = \sum_{\text{k}} L_{\text{ik}} X_{\text{k}} \]
Les \(L_{\text{ik}}\) sont les coefficients phénoménologiques. Les coefficients diagonaux (\(L_{\text{ii}}\)) lient un flux à sa force "naturelle" (ex: \(L_{\text{qq}}\) pour la loi de Fourier). Les coefficients non-diagonaux (\(L_{\text{ik}}\) avec \(\text{i} \neq \text{k}\)) décrivent les couplages.
3. Relations de Réciprocité d'Onsager :
Ce postulat fondamental, récompensé par un prix Nobel, stipule que la matrice des coefficients phénoménologiques est symétrique :
\[ L_{\text{ik}} = L_{\text{ki}} \]
Cela signifie que l'influence de la force \(\text{k}\) sur le flux \(\text{i}\) est la même que l'influence de la force \(\text{i}\) sur le flux \(\text{k}\). C'est ce qui relie l'effet Dufour (chaleur due au \(\nabla C\)) à l'effet Soret (matière due au \(\nabla T\)).
Correction : Calcul du Flux de Chaleur par Effet Dufour
Question 1 : Identifier les flux et les forces
Principe (le concept physique)
Dans notre système, deux processus de transport se produisent : un transfert de matière (diffusion des gaz l'un dans l'autre) et un transfert de chaleur. La TPI nous demande d'identifier la "cause" (la force) et la "conséquence" (le flux) pour chaque processus. La cause du transfert de chaleur est un gradient de température, et la cause du transfert de matière est un gradient de potentiel chimique (ou plus simplement, de concentration).
Mini-Cours (approfondissement théorique)
Les forces thermodynamiques sont définies précisément à partir de la dérivée de l'entropie par rapport aux variables extensives. Pour le transfert de chaleur et de matière, les forces conjuguées sont \(X_{\text{q}} = \nabla(1/T)\) et \(X_{\text{1}} = -\nabla(\mu_{\text{1}}/T)\). Pour de faibles gradients et à T constant, on peut simplifier ces expressions en utilisant directement le gradient de température \(\nabla T\) et le gradient de concentration \(\nabla x_{\text{1}}\), ce qui est plus intuitif et mène aux lois de transport usuelles.
Remarque Pédagogique (le conseil du professeur)
Imaginez une pièce avec un parfum diffusé d'un côté. C'est le gradient de concentration qui pousse les molécules de parfum à se déplacer : c'est la force de diffusion. Si en plus un côté de la pièce est chauffé, les molécules bougeront différemment. La TPI nous dit que ces deux phénomènes ne sont pas indépendants : le flux de parfum peut créer un léger flux de chaleur (Dufour) et le flux de chaleur peut créer un léger flux de parfum (Soret).
Normes (la référence réglementaire)
Il n'y a pas de "norme" au sens industriel pour ce concept fondamental. Cependant, la formulation des flux et des forces est standardisée dans les ouvrages de référence de la thermodynamique hors équilibre, notamment les travaux de de Groot & Mazur ou de Prigogine.
Formule(s) (l'outil mathématique)
L'identification est conceptuelle. On liste les couples flux/force pertinents.
Hypothèses (le cadre du calcul)
On se place dans le cadre de la thermodynamique des processus irréversibles linéaires. On suppose que le système est suffisamment proche de l'équilibre pour que les flux soient des fonctions linéaires des forces.
Donnée(s) (les chiffres d'entrée)
Aucune donnée numérique n'est nécessaire pour cette question conceptuelle.
Astuces(Pour aller plus vite)
Pour identifier les couples flux/force, pensez aux lois de base : la loi de Fourier relie le flux de chaleur (\(J_{\text{q}}\)) au gradient de température (\(\nabla T\)). La loi de Fick relie le flux de matière (\(J_{\text{1}}\)) au gradient de concentration (\(\nabla x_{\text{1}}\)). Ce sont les couples "diagonaux" évidents.
Schéma (Avant les calculs)
Couplage Flux / Forces
Calcul(s) (l'application numérique)
Cette étape est purement descriptive.
Schéma (Après les calculs)
Le schéma conceptuel reste le même.
Réflexions (l'interprétation du résultat)
Nous avons un système avec deux flux et deux forces potentiels. Même si l'énoncé précise que le système est isotherme (\(\nabla T = 0\)), il est crucial de considérer la force \(\nabla T\) dans les équations initiales pour pouvoir décrire les effets croisés. L'effet Dufour est précisément le couplage entre la force de concentration \(\nabla x_{\text{1}}\) et le flux de chaleur \(J_{\text{q}}\).
Points de vigilance (les erreurs à éviter)
Ne pas oublier de flux ou de force. Dans un système avec température, concentration et potentiel électrique, il y aurait 3 flux et 3 forces, et donc potentiellement 3x3=9 coefficients phénoménologiques à considérer.
Points à retenir (permettre a l'apprenant de maitriser la question)
- Flux de chaleur : \(J_{\text{q}}\) (en \(\text{W} \cdot \text{m}^{-2}\))
- Flux de matière (constituant 1) : \(J_{\text{1}}\) (en \(\text{mol} \cdot \text{m}^{-2} \cdot \text{s}^{-1}\))
- Force thermique : \(X_{\text{q}}\), proportionnelle à \(\nabla T\)
- Force de diffusion : \(X_{\text{1}}\), proportionnelle à \(\nabla x_{\text{1}}\)
Le saviez-vous ? (la culture de l'ingénieur)
Les effets thermoélectriques (Seebeck, Peltier, Thomson) sont un autre exemple célèbre de couplage TPI, cette fois entre flux de chaleur et flux de charge électrique. Ils sont à la base des thermocouples et des modules de refroidissement thermoélectriques.
FAQ (pour lever les doutes)
Résultat Final (la conclusion chiffrée)
A vous de jouer(pour verifier la comprehension de l'etudiant parrapport a la question)
Dans un système avec un gradient de température et un gradient de potentiel électrique, quel est le nom de l'effet qui crée un flux de chaleur à partir du gradient électrique ?
Question 2 : Écrire les équations phénoménologiques
Principe (le concept physique)
Maintenant que nous avons identifié les flux et les forces, nous écrivons la relation la plus générale qui les lie, en supposant une dépendance linéaire. Chaque flux est une somme de contributions de chaque force. C'est ici que les effets de couplage apparaissent mathématiquement à travers les coefficients non-diagonaux.
Mini-Cours (approfondissement théorique)
La forme la plus rigoureuse des équations utilise les forces conjuguées \(X_{\text{q}}\) et \(X_{\text{1}}\). Cependant, pour des applications pratiques, il est courant de les réécrire en fonction des gradients mesurables (\(\nabla T, \nabla x_{\text{1}}\)). Cette transformation fait apparaître les coefficients de transport usuels (\(\lambda, D_{\text{12}}, D_{\text{T}}, D''\)) qui sont directement liés aux coefficients \(L_{\text{ik}}\) mais ont des unités plus physiques.
Remarque Pédagogique (le conseil du professeur)
Voyez ces équations comme une "recette" pour chaque flux. La "recette" du flux de chaleur \(J_{\text{q}}\) est : "Prenez une part de gradient de température (Fourier), et ajoutez-y une part de gradient de concentration (Dufour)". De même pour le flux de matière \(J_{\text{1}}\). Les coefficients sont les "dosages" de chaque ingrédient.
Normes (la référence réglementaire)
La formulation présentée est standard dans la littérature scientifique et technique sur les phénomènes de transport. Les notations peuvent légèrement varier d'un auteur à l'autre, mais la structure matricielle \(J = L \cdot X\) est universelle.
Formule(s) (l'outil mathématique)
En utilisant des coefficients de transport pratiques, les équations phénoménologiques s'écrivent :
Où \(D''\) est le coefficient de Dufour et \(D_{\text{T}}\) est le coefficient de thermodiffusion (Soret).
Hypothèses (le cadre du calcul)
On suppose que les coefficients de transport (\(\lambda, D'', D_{\text{T}}, D_{\text{12}}\)) sont constants et ne dépendent pas de la position ou de la concentration locale, ce qui est une bonne approximation pour de faibles gradients.
Donnée(s) (les chiffres d'entrée)
Cette question est une écriture formelle et ne nécessite pas de données numériques.
Astuces(Pour aller plus vite)
Pour se souvenir de la structure, écrivez les flux et les forces en colonne, puis remplissez la matrice des coefficients. La diagonale correspond aux lois "classiques" (Fourier, Fick). Les termes hors diagonale sont les effets "croisés" (Soret, Dufour).
Schéma (Avant les calculs)
Forme Matricielle des Équations
Calcul(s) (l'application numérique)
Pas de calcul numérique pour cette étape.
Schéma (Après les calculs)
Le schéma reste le même.
Réflexions (l'interprétation du résultat)
Ces deux équations forment un système couplé. Elles montrent clairement que même si \(\nabla T = 0\), il peut y avoir un flux de chaleur \(J_{\text{q}}\) si \(\nabla x_{\text{1}} \neq 0\). De même, même si \(\nabla x_{\text{1}} = 0\), il peut y avoir un flux de matière \(J_{\text{1}}\) si \(\nabla T \neq 0\). C'est toute la richesse de l'approche par la TPI.
Points de vigilance (les erreurs à éviter)
Attention aux signes ! Par convention, un flux est positif s'il va dans la direction des x croissants, tandis qu'un gradient est positif si la quantité augmente avec x. La loi de Fourier est \(J_{\text{q}} = -\lambda \nabla T\) car la chaleur s'écoule des hautes vers les basses températures (dans le sens opposé au gradient). Les signes dans la matrice sont choisis pour respecter ces conventions.
Points à retenir (permettre a l'apprenant de maitriser la question)
- Chaque flux est une combinaison linéaire de toutes les forces.
- Le terme \(-\lambda \nabla T\) est la contribution de Fourier au flux de chaleur.
- Le terme \(-c T D'' \nabla x_{\text{1}}\) est la contribution de Dufour au flux de chaleur.
Le saviez-vous ? (la culture de l'ingénieur)
Dans les milieux poreux, comme les sols ou les matériaux de construction, ces équations se complexifient encore car il faut prendre en compte les couplages avec le flux de fluide global (loi de Darcy). On parle alors de thermo-poro-mécanique, un domaine essentiel en géothermie ou en génie civil.
FAQ (pour lever les doutes)
Résultat Final (la conclusion chiffrée)
\(J_{\text{q}} = -\lambda \nabla T - c T D'' \nabla x_{\text{1}}\)
\(J_{\text{1}} = -c D_{\text{T}} \nabla T - c D_{\text{12}} \nabla x_{\text{1}}\)
A vous de jouer(pour verifier la comprehension de l'etudiant parrapport a la question)
Dans l'équation pour \(J_{\text{1}}\), quel terme représente la loi de Fick ?
Question 3 : Utiliser la relation d'Onsager
Principe (le concept physique)
La relation de réciprocité d'Onsager (\(L_{\text{ik}}=L_{\text{ki}}\)) est un postulat puissant qui relie des effets a priori déconnectés. Ici, elle va nous permettre de lier le coefficient de l'effet Dufour (influence de \(\nabla x_{\text{1}}\) sur \(J_{\text{q}}\)) au coefficient de l'effet Soret (influence de \(\nabla T\) sur \(J_{\text{1}}\)). Cela signifie que si nous pouvons mesurer l'un, nous pouvons calculer l'autre. C'est une symétrie fondamentale de la nature au voisinage de l'équilibre.
Mini-Cours (approfondissement théorique)
En comparant les deux formes des équations phénoménologiques (celle avec les \(L_{\text{ik}}\) et celle avec les coefficients de transport), on peut montrer que \(L_{\text{q1}} \propto c T D''\) et \(L_{\text{1q}} \propto c D_{\text{T}}\). La relation \(L_{\text{1q}} = L_{\text{q1}}\) se traduit alors directement par une relation simple entre \(D_{\text{T}}\) et \(D''\). Cette symétrie n'est pas évidente physiquement mais a été démontrée par Onsager sur la base de la réversibilité microscopique des fluctuations statistiques à l'équilibre.
Remarque Pédagogique (le conseil du professeur)
C'est un peu comme une "loi de la réciprocité" en économie : si une hausse du prix du blé fait monter le prix du pain, alors une hausse du prix du pain devrait (d'une certaine manière) influencer le prix du blé. Onsager a prouvé que cette "sympathie" entre phénomènes couplés est une loi fondamentale de la physique pour les processus irréversibles.
Normes (la référence réglementaire)
La validité des relations d'Onsager est un pilier de la TPI et est acceptée comme un principe de base dans tous les domaines où ces phénomènes sont étudiés, de la chimie-physique à l'ingénierie.
Formule(s) (l'outil mathématique)
La relation de réciprocité d'Onsager appliquée à nos coefficients de transport se traduit par l'égalité directe :
Le coefficient de Dufour est simplement égal au coefficient de thermodiffusion (Soret). C'est un résultat remarquable de la TPI.
Hypothèses (le cadre du calcul)
Cette relation n'est valide que si les flux et les forces ont été correctement choisis pour que la production d'entropie s'écrive \(\sigma = \sum J_{\text{i}} X_{\text{i}}\). C'est le cas de la formulation standard utilisée ici.
Donnée(s) (les chiffres d'entrée)
- Coefficient de diffusion thermique, \(D_{\text{T}} = 1.5 \times 10^{-8} \, \text{m}^2 \cdot \text{s}^{-1} \cdot \text{K}^{-1}\)
Astuces(Pour aller plus vite)
Dans les problèmes de TPI, cherchez toujours la paire d'effets réciproques : Soret/Dufour (thermo/diffusion), Seebeck/Peltier (thermo/électricité), etc. La relation d'Onsager vous donnera presque toujours une égalité ou une relation simple entre les coefficients croisés, ce qui simplifie grandement le problème.
Schéma (Avant les calculs)
Symétrie de la Matrice des Coefficients
Calcul(s) (l'application numérique)
Il s'agit d'une simple identification.
Schéma (Après les calculs)
Égalité des Coefficients Croisés
Réflexions (l'interprétation du résultat)
Ce résultat est puissant car il signifie qu'un effet (Dufour) peut être quantifié en mesurant son effet réciproque (Soret), qui est souvent plus facile à mettre en évidence expérimentalement. Cela réduit de moitié le nombre de coefficients indépendants à mesurer pour caractériser un système binaire.
Points de vigilance (les erreurs à éviter)
La relation simple \(D'' = D_{\text{T}}\) n'est pas universelle pour toutes les définitions de coefficients. Elle dépend de la manière dont les flux et les forces ont été définis. Cependant, avec la formulation standard utilisée dans cet exercice, elle est correcte.
Points à retenir (permettre a l'apprenant de maitriser la question)
- Le postulat d'Onsager stipule que \(L_{\text{ik}} = L_{\text{ki}}\).
- Ce postulat implique une relation simple entre les coefficients des effets croisés.
- Pour la diffusion et la chaleur, cela se traduit par \(D'' = D_{\text{T}}\).
Le saviez-vous ? (la culture de l'ingénieur)
Lars Onsager a reçu le prix Nobel de chimie en 1968 pour ces relations de réciprocité, qu'il avait publiées dès 1931. Il a fallu des décennies pour que l'importance de ses travaux soit pleinement reconnue par la communauté scientifique.
FAQ (pour lever les doutes)
Résultat Final (la conclusion chiffrée)
A vous de jouer(pour verifier la comprehension de l'etudiant parrapport a la question)
Si le coefficient de Soret \(D_{\text{T}}\) était de \(2.1 \times 10^{-8}\), quelle serait la valeur du coefficient de Dufour \(D''\) ? (en \(10^{-8} \, \text{m}^2 \cdot \text{s}^{-1} \cdot \text{K}^{-1}\))
Question 4 : Calculer le flux de chaleur \(J_{\text{q}}\)
Principe (le concept physique)
Maintenant que nous avons tous les éléments, nous pouvons calculer le flux de chaleur. Nous utilisons l'équation de \(J_{\text{q}}\) et nous y insérons les conditions de notre expérience. Comme le système est isotherme, le terme de Fourier (\(-\lambda \nabla T\)) est nul. Le seul flux de chaleur existant est celui créé par le gradient de concentration, c'est-à-dire l'effet Dufour pur.
Mini-Cours (approfondissement théorique)
Le calcul final est une application directe de l'équation phénoménologique pour \(J_{\text{q}}\). Il met en évidence que même en l'absence de la force "naturelle" (\(\nabla T=0\)), un flux de chaleur peut exister s'il est "entraîné" par une autre force (\(\nabla x_{\text{1}}\)) à travers un coefficient de couplage non nul. C'est l'essence même des phénomènes de transport couplés.
Remarque Pédagogique (le conseil du professeur)
C'est le moment de vérité où la théorie se transforme en un chiffre concret. Ce calcul, bien que simple, représente le point culminant de notre raisonnement : quantifier un phénomène non intuitif. Le signe du résultat est aussi important que sa valeur : il nous dira dans quelle direction la chaleur se déplace à cause de la diffusion.
Normes (la référence réglementaire)
Les unités du Système International (SI) doivent être utilisées de manière cohérente pour que le résultat soit correct. Ici, nous utilisons des K, m, s, mol, W, ce qui garantit un résultat final en \(\text{W} \cdot \text{m}^{-2}\) sans conversion.
Formule(s) (l'outil mathématique)
On part de l'équation du flux de chaleur en annulant le terme de Fourier :
Hypothèses (le cadre du calcul)
On suppose que le gradient de concentration est la seule force thermodynamique non nulle dans le système. On néglige tout autre effet potentiel (gravité, champs externes, etc.).
Donnée(s) (les chiffres d'entrée)
- Condition de l'expérience : \(\nabla T = 0\)
- Coefficient de Dufour, \(D'' = 1.5 \times 10^{-8} \, \text{m}^2 \cdot \text{s}^{-1} \cdot \text{K}^{-1}\) (de Q3)
- Température, \(T = 300 \, \text{K}\)
- Concentration totale, \(c = 40 \, \text{mol} \cdot \text{m}^{-3}\)
- Gradient de fraction molaire, \(\nabla x_{\text{1}} = -0.8 \, \text{m}^{-1}\)
Astuces(Pour aller plus vite)
Faites attention aux doubles négatifs. Ici, le gradient \(\nabla x_{\text{1}}\) est négatif, et il y a un signe moins dans la formule. Le résultat final sera donc positif. Penser au sens physique : si le gaz léger (He) diffuse vers la droite (\(J_{\text{1}} > 0\)) et que le coefficient de Dufour est positif, le flux de chaleur sera dans la même direction.
Schéma (Avant les calculs)
Calcul du Flux de Chaleur Final
Calcul(s) (l'application numérique)
On remplace par les valeurs numériques :
Schéma (Après les calculs)
Visualisation du Résultat
Réflexions (l'interprétation du résultat)
Le flux de chaleur est de \(+1.44 \times 10^{-4} \, \text{W} \cdot \text{m}^{-2}\). Le signe positif signifie que le flux de chaleur va dans la direction des x croissants. C'est la direction opposée au flux net d'Hélium (qui diffuse des zones riches, à gauche, vers les zones pauvres, à droite, donc dans le sens des x croissants aussi, mais son gradient est négatif). La valeur est faible, ce qui confirme que cet effet est souvent un phénomène de second ordre, mais mesurable et important dans certaines applications spécifiques.
Points de vigilance (les erreurs à éviter)
La principale erreur serait une faute de signe ou une erreur de calcul avec les puissances de dix. Vérifiez toujours que les unités de chaque terme se combinent pour donner l'unité du flux (\(\text{W} \cdot \text{m}^{-2}\)). Ici : \((\frac{\text{mol}}{\text{m}^3}) \cdot \text{K} \cdot (\frac{\text{m}^2}{\text{s} \cdot \text{K}}) \cdot (\frac{1}{\text{m}}) = \frac{\text{mol}}{\text{m} \cdot \text{s}}\). Il manque un facteur pour arriver aux Watts. C'est parce que la force rigoureuse contient un facteur RT (énergie/mol), ce qui est implicitement inclus dans les coefficients. C'est un point subtil de la TPI.
Points à retenir (permettre a l'apprenant de maitriser la question)
- Le flux de Dufour est calculé avec le terme croisé de l'équation du flux de chaleur.
- En conditions isothermes, c'est la seule contribution au flux de chaleur.
- Le signe du résultat indique la direction du flux de chaleur par rapport aux axes.
Le saviez-vous ? (la culture de l'ingénieur)
Dans les modèles de combustion, l'effet Dufour peut jouer un rôle non négligeable. Les gradients de concentration des espèces chimiques (carburant, oxydant, produits) sont extrêmement élevés dans un front de flamme, ce qui peut générer des flux de chaleur significatifs qui modifient la structure et la vitesse de la flamme.
FAQ (pour lever les doutes)
Résultat Final (la conclusion chiffrée)
A vous de jouer(pour verifier la comprehension de l'etudiant parrapport a la question)
Si le gradient de fraction molaire était deux fois moins intense (\(\nabla x_{\text{1}} = -0.4 \, \text{m}^{-1}\)), quel serait le nouveau flux de chaleur en \(\text{W} \cdot \text{m}^{-2}\) ?
Outil Interactif : Paramètres de l'Effet Dufour
Modifiez les paramètres pour voir leur influence sur le flux de chaleur induit.
Paramètres d'Entrée
Résultats Clés
Le Saviez-Vous ?
L'effet réciproque, l'effet Soret (ou thermodiffusion), est utilisé industriellement pour la séparation isotopique. En appliquant un fort gradient de température à un mélange de gaz (comme l'hexafluorure d'uranium), les isotopes plus légers (U-235) migrent préférentiellement vers la paroi chaude, permettant leur enrichissement.
Foire Aux Questions (FAQ)
Pourquoi l'effet Dufour est-il souvent négligé ?
Le coefficient de Dufour est généralement petit. Le flux de chaleur qu'il génère est souvent masqué par le flux de chaleur beaucoup plus important dû à la conduction thermique (loi de Fourier), sauf dans des situations où le gradient de température est quasi nul mais le gradient de concentration très élevé. C'est pourquoi il est surtout pertinent dans des contextes de laboratoire ou des applications très spécifiques.
La relation d'Onsager est-elle toujours valide ?
Les relations de réciprocité d'Onsager sont considérées comme un quatrième principe de la thermodynamique pour les systèmes proches de l'équilibre. Elles sont extrêmement bien vérifiées expérimentalement. Elles ne s'appliquent cependant plus dans les régimes dits "loin de l'équilibre", où des relations non-linéaires et des structures dissipatives (comme les cellules de Bénard) peuvent apparaître.
Quiz Final : Testez vos connaissances
1. L'effet Dufour décrit un flux de...
2. La relation de réciprocité d'Onsager relie l'effet Dufour à...
- Effet Dufour
- Phénomène de transport couplé où un gradient de concentration dans un mélange induit un flux de chaleur.
- Effet Soret (Thermodiffusion)
- Phénomène réciproque de l'effet Dufour, où un gradient de température dans un mélange induit un flux de matière et donc un gradient de concentration.
- Relations de Réciprocité d'Onsager
- Principe fondamental de la TPI stipulant que la matrice des coefficients phénoménologiques reliant les flux et les forces est symétrique (\(L_{\text{ik}}=L_{\text{ki}}\)).
D’autres exercices de Thermodynamique irréversibles:



0 commentaires